文|陈根
作为对人类健康造成最重大威胁的疾病之一,一直以来,癌症都是各国科学家们的重点研究方向。世界卫生组织国际癌症研究署(IAR)发布的全球最新癌症预估数据显示,2020 年全球新发癌症病例 1929 万例,死亡病例 996 万例。寻找癌症预防和治疗的有效手段,依然刻不容缓。
尽管人类与癌症的斗争史非常漫长,但时至今日,癌症依然是一类让我们感到畏惧的疾病——癌症在基因水平上千变万化,而人们用于治疗的药物和手段还非常有限。传统的癌症治疗主要是手术、放疗和化疗,但随着医学科学的进步,免疫治疗、细胞治疗等治疗方式不断涌现,也为癌症患者提供了新的治疗途径。
其中,细胞疗法作为第三代医疗手段,利用免疫细胞抗癌的过继性免疫细胞治疗,正在异军突起,展现出巨大的前景。
细胞疗法走向临床
从细胞水平到分子水平,是人类认识生命本质的一次飞跃;从分子水平回到细胞水平,人类更加理解细胞的行为,并且可以有目的地改造它用于疾病的治疗,比如干细胞,又或者免疫细胞。其中,肿瘤的免疫细胞疗法正在异军突起,展现巨大的开发潜力。
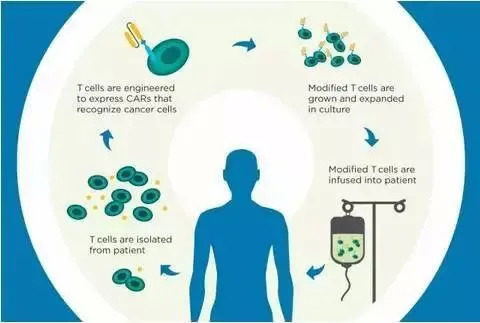
免疫细胞疗法是从患者体内取出具有抗癌能力的T细胞,在体外进行增殖,然后再注射回患者体内,从而达到清除肿瘤细胞的作用。免疫细胞疗法不同于常规的放疗、化疗,由于回注体内的T细胞只针对肿瘤细胞高度特异性清除,对于身体的伤害较小,因此也成为目前极具潜力和挑战的疗法。
当然,肿瘤免疫细胞疗法也不是一个一蹴而就的过程。从免疫细胞疗法的技术更新来看,免疫细胞疗法至少经历了细胞因子技术、细胞技术、CIK细胞技术、CAR-T细胞技术四个阶段。
从1976年Morgan等人发现白介素2 (IL-2)对T 细胞的扩增效应并大量生产后,科学家就开始利用IL-2诱导出LAK(Lymphokine Activated Killer)细胞,用于治疗黑色素瘤、肺癌等多种恶性肿瘤。这是最早的肿瘤免疫细胞治疗方法。
但是,因为LAK细胞需要依赖大剂量的IL-2,治疗副作用较大,最常见和最严重的毒副作用是出现毛细血管渗漏综合征(CLS),主要表现为全身性水肿和多器官功能失调,可引起胸腹腔积液、肺间质水肿和充血性心力衰竭。因此,研究人员开始寻找更适合的肿瘤免疫细胞治疗方法。
比如,在LAK 疗法后,Rosenberg 等人从肿瘤附近组织中分离出TIL(tumor-infiltrating lymphocytes)细胞。与LAK疗法相比,TIL 疗法具有一定的肿瘤特异性,临床效果优于LAK 疗法,小鼠实验证实其杀瘤效果比LAK高50-100倍。TIL技术体系比较复杂,培养成功率不高,极大地限制了临床应用。
1991年斯坦福大学医学院骨髓移植中心报道了具有高增殖力和高细胞毒性的CIK(Cytokine Induced Killer)细胞。CIK技术的出现,首次摆脱了细胞培养及回输过程中对大剂量IL-2的依赖,明显减少了患者的临床副反应。
在国内,CIK技术大力发展,已有超过五百家医院将CIK及CIK基础上的细胞治疗技术用于肿瘤患者的治疗,并证实CIK技术能明显改善患者生活质量,延长晚期肿瘤患者的生存期。
此后的DC 和CIK 治疗联用,构建出了肿瘤特异的杀伤性T 细胞。自此开始,细胞治疗进入了一个“个体化,精准化”的阶段。随着基因技术的发展,科学家尝试以病毒为载体对T细胞进行改造。从患者体内提取T细胞进行体外扩增的同时,向T细胞插入新的基因,增强它们识别攻击肿瘤细胞的能力。
CAR疗法就是通过基因转导使患者的T细胞能够表达嵌合抗原受体CAR,将改造后的T细胞回输至患者体内,生成大量特异性识别肿瘤的CAR-T细胞从而杀死肿瘤细胞。CAR-T细胞以非MHC限制性的方式识别肿瘤细胞,因此得到了更广泛的应用。到目前为止,CAR 载体构建已发展到第4 代,具有更好的特异性。
自体免疫与异体免疫
作为免疫细胞疗法的重要类型之一,近年来,基于工程改造的嵌合抗原受体T(CAR-T)细胞取得了关键的突破,数个疗法接连获批,受到了市场的广泛关注。根据供体来源,CAR-T疗法可以分为自体细胞疗法和异体细胞疗法。
目前获批的几款CAR-T疗法都是“自体细胞疗法”。自体细胞疗法先要从病患体内获得足够数量和质量的T细胞,进行工程化改造,使之成为CAR-T细胞,随后,扩增到足够的治疗剂量,再重新输入回患者的体内,展开对癌症的治疗。从免疫的视角来看,理论上经过工程化的自体T细胞可以在体内发挥更长时间的作用,不会产生机体的排斥反应或被机体很快清除。
2017年,CAR-T疗法迎来成功上市的先行者,来自Novartis的Kymriah用于治疗复发或难治性B细胞急性淋巴细胞白血病(ALL)。之后来自Kite Pharma的Yescarta和Tecartus也成功上市,分别用于治疗复发/难治性惰性非霍奇金淋巴瘤(NHL)复发/难治性套细胞淋巴瘤(MCL)成人患者。
行业壁垒的成功突破,带动了此后更多疗法问世,更多的自体细胞疗法提上研发日程,进入临床研究中。目前,这种方法已经取得一系列喜人的临床结果。
自体CAR-T疗法也有着一些天然的应用局限。由于自体免疫细胞的来源为患者本人,因而自体的CAR-T治疗策略对患者本身的要求非常高,这成为了自体细胞疗法广泛应用的巨大挑战,比如,有些患者病情严重,体内已经没有足够质量和数量的T细胞用于工程化改造。
自体细胞疗法的开发和制备需要数周的时间,这个等待时间,对于进展迅速的疾病来说,是巨大的风险;比如急性白血病患者,可能在等待自体细胞疗法的时间里疾病迅速恶化。
另外,由于T细胞功能障碍,自体T细胞可能在一些患者中无效,这与癌症微环境产生的多种免疫抑制机制有关。自体T细胞的生物学特性也受到以往治疗的负面影响。虽然,接受治疗前会经过谨慎的评估,但可以预见,受限于患者自身的条件,短期内由自体T细胞生产的细胞疗法还很难成为一把“万能钥匙”。
异体细胞疗法,也称为通用型细胞疗法。与自体细胞疗法不同,异体细胞疗法所使用的T细胞来自于健康的第三方供体,因而这些细胞没有受到癌症及化疗药物的影响,相对于患者自身的细胞更为健康。
事实上,通用型CAR-T产品正是在自体CAR-T的技术基础上进行研发。不同于自体CAR-T中所使用的病人体内可能已经大量功能受损的免疫细胞,以健康供体或多能干细胞为来源的通用型CAR-T产品拥有更强力、稳定的T细胞,拥有更强的肿瘤杀伤作用的同时也大大降低了提取T细胞和制备CAR-T的难度,提高了CAR-T在临床中的成功率。
而批量化生产制备、“立等可取”则是通用型CAR-T更大的优势所在。批量化的生产在一定程度上保证了细胞产品的稳定性和一致性,更好地保障了这一疗法的治疗效果,使CAR-T疗法得以成为一种“药品”。
其“立等可取”的特性更是为癌症晚期的患者带来希望,因为现有的自体CAR-T疗法长达2-3周的制备时间可能会贻误患者的最佳治疗时机。因此,通用型CAR-T更能满足临床上的需求。
目前,中国已经有335个进行中的CAR-T临床试验,其中包括19个通用型的CAR-T产品。这些通用型的CAR-T产品中,7个产品仍然在临床前研发阶段,1个产品在进行新药临床试验申请,11个产品处于临床I期或I/II期,总体研发阶段仍在早期阶段。
尽管从临床上而言,患者和相关研究人员都对通用型细胞疗法寄予了厚望,然而在未来的商业化过程中通用型细胞疗法仍然面临着诸多挑战。
首先,通用型免疫细胞作为异体细胞,在回输到患者体内后会被宿主体内的免疫系统消除,这一问题对于不能在宿主体内扩增、且本身生理周期就较短的NK细胞而言更为严重,极大地限制了细胞疗法的作用。
其次,细胞疗法有复杂的生产过程,同时在生产过程中需要严格的制备工艺和质量管理,尽管与自体细胞疗法相比,通用型细胞疗法通过规模化、批量化生产可在一定程度上降低成本,但总体生产费用依然高昂。同时,通用型的细胞疗法涉及到储存和物流的步骤,在冻存和复苏的过程中,相当一部分细胞会失活甚至死亡,因此需要增加输入量,进一步提升生产成本。
最后,细胞疗法的相关注册方法包括按照新药进行注册或按照医疗技术进行注册。然而,按医疗技术注册的细胞疗法主体需为医疗机构,在商业化方面也将有很多限制。而国内尚无按照新药进行注册的细胞疗法产品上市,进展最快的CAR-T产品为复星凯特的Yescarta,该产品的NDA申请在2020年2月获得NMPA的受理,目前尚未获批。
细胞疗法的临床路径仍然有待验证。此外,我国明令禁止血液制品的交易,相关企业如何获得用于细胞疗法的免疫细胞也是一个悬而未决的问题。
不可否认,数十年来基础免疫学、遗传工程学、基因编辑技术和合成生物学领域的蓬勃发展,都为T细胞免疫治疗的发展与应用提供了有益的发展契机。尽管当前T细胞免疫治疗犹有困境。
但从现有的研究来看,细胞疗法的优势是明显的,我们有理由相信,随着医学研究的进步,细胞疗法很可能会和化疗、放疗一样,成为许多肿瘤的常规治疗手段。人类长期抑制、甚至治愈肿瘤的梦想也是有可能实现的。