文|陈根
据世界卫生组织国际癌症研究机构(IARC)发布的最新数据显示,每年全球癌症死亡病例高达 996 万例。作为对人类健康造成最重大威胁的疾病之一,直到今天,癌症都是各国科学家们的重点研究方向。
人类与癌症的斗争历史非常漫长,即便是现在,癌症依然是一类让我们感到畏惧的疾病——癌症在基因水平上千变万化,而人们用于治疗的药物和手段还非常有限。不过,随着医学科学的进步,越来越多的治疗方式不断涌现,为癌症患者提供了新的治疗途径。基因编辑疗法和个性化治疗成为攻克癌症最具希望的治疗手段之一,现在,科学家们更是成功把这两种治疗方法结合在了一起。
攻克癌症需要个性化治疗
癌症的治疗往往就是在碰运气。尽管当前,现代医学已经在肿瘤遗传学方面取得了诸多进展,但内科医生在面对一位具体的患者时,作出诊断治疗所能依据的信息依然非常有限。接受治疗的患者甚至只能祈求保佑,因为没有人知道这些疗法对他们是有用还是有害。
事实是,癌症治疗常常面临失败,这是因为不同的个体具有不同的遗传背景。尽管当前人们对癌症的病因尚未完全了解。但从分子生物学的角度来说,癌变意味着由一连串 DNA 受损而引发的细胞分裂速率失控。当调控细胞生长的基因发生突变或损坏时,细胞便开始了持续的、不受控制的生长及分裂。
对不同患者来说,个人基因组的不同也对病情的进展有着不同的影响。2016 年,Ian F. Tannock和 John A. Hickman在《新英格兰医学杂志》(NEJM)撰文指出,即使在单个肿瘤中,癌细胞的基因组成在不同区域之间也存在显著差异,这就是困扰科学家们的肿瘤异质性。
肿瘤异质性是指肿瘤在生长过程中,经过多次分裂增殖,其子细胞呈现出分子生物学或基因方面的改变,从而使肿瘤的生长速度、侵袭能力、对药物的敏感性以及预后等各方面产生差异。
也就是说,即使是同一位癌症患者,肿瘤细胞也会根据处于身体的不同位置而发生变化,甚至同一肿瘤内的肿瘤细胞也有细微甚至显著不同。这就导致除了造成癌症患者整体预后的巨大差别,还导致每个患者对相同的治疗手段应答的不同。同一种治疗手段,用在这个人身上恰到好处,用在另一个人身上就可能是无效的甚至是有害的。即便是用在同一个人身上,使用的时间和顺序不一样,结果也可能完全相反。这就是临床上看到的对同一个治疗方案应答难以预测的原因。
比如,对于乳腺癌患者来说,HER2基因的突变会导致人类表皮生长因子受体 2 (HER2)在大约15-30%的浸润性乳腺癌中过度表达。乳腺癌细胞的 HER2 蛋白可增加 40-100 倍,导致细胞表面表达约 200 万个受体。
因此,癌症才被认为是一类个性化的疾病。迄今为止,全世界主流医学对于癌症的临床治疗模式,主要是由“试验”主导的,一种方法不行就换另外一种。而在个性化癌症治疗中,内科医生就可以根据每位患者癌症类型具备的独特特性,给出相应的治疗措施。
比如,结肠癌患者治疗时常常要使用一种针对生长因子受体的特定抗体。尽管这种昂贵的疗法延长了病人的生命,并使一些患者感觉好转,但该疗法发挥效力的前提是,患者体内的K-ras基因不能发生突变。因此,如果内科医生在为患者开药之前检查K-ras基因的突变状况,就能给适合的患者开药,而不给不适合的患者开药,从而节省他们的花销。
基于基因编辑的个性化治疗
个性化治疗许诺了癌症治疗的无限前景,而个性化癌症治疗的理论基础是,每个人的基因都有差异,而且引发癌症的基因也是千差万别,即便是同一种癌症,每个人的致癌基因都有不同。
因此,想要实现个性化治疗,还需要对患者进行基因测序,以确定数千种可能的基因突变中的致癌基因,然后研发可以靶向致癌基因的药物。
从理论上看,尽管这是一种良好的对症用药的方式,但在现实中,这却难以做到。显然,医生不可能对每位患癌者,如肺癌都设计和研发不同的药物,也没有谁负担得起这样的研发经费和药价。
目前,现实的做法是,对一类癌症进行不同亚型的分类,比如,肺癌主要分为2种类型,小细胞肺癌(SCLC)和非小细胞肺癌(NSCLC)。大多数肺癌是非小细胞肺癌,其本身又细分为三类:鳞状细胞癌、腺癌和肺细胞癌。因此,针对肺癌的药物研发和临床使用细分也只是这几类。
哥伦比亚大学的一项研究结果就证明,癌症需要分类,但并非是千人千面,而是可以确定为一定的类型,即所有癌症都可分为112种亚型,而且有24种独特而关联度较高的主要模块(主调节蛋白)控制。这样以来,就可以研发靶向主调节蛋白的新药物,治疗更多的同类癌症病人。
但这也让我们看到,当前的个性化治疗依然是一种不够精确的大众化治疗,而非个性化治疗。临床实践也表明,仅仅依靠识别基因突变来指导个性化治疗,结果并不乐观。个性化治疗只能让5%-10%的患者受益,他们中的大多数人最终会发展为耐药性肿瘤。
于是,为了更加精确地靶向癌细胞,科学家们把目光转向了基因编辑,试图通过基因编辑来进行精准的个性化治疗。
在这样的设想下,韩国基础科学研究所(IBS)基因组完整性中心(CGI)的研究人员提出,通过利用CRISPR-Cas9,在只存在于癌细胞中的癌症特异性突变处产生DNA双链断裂,他们提出了一种在癌细胞中触发细胞死亡而不影响正常细胞的假设。MYUNG Kyungjae、KWON Taejon和CHO Seung Woo领导的CGI联合研究团队证明了这一假设的可行性。研究团队开发了一种名为CINDELA(Cancer-specific INDEL Attacker)的创新方法,该方法可攻击癌症特异性突变,导致多个DNA双链断裂,从而特异性诱导癌细胞死亡。研究人员希望CINDELA可以成为大多数肿瘤中个性化癌症治疗的潜在方法。
2022 年 11 月,美国加州大学及一家免疫肿瘤疗法公司的研究人员在 Nature 以加速预览的形式也报道了相关的癌症治疗突破。研究人员利用 CRISPR-Cas9 基因编辑技术改造了T细胞,使其能特异性识别癌细胞并发动集中攻击,并开展了首次人体临床试验。
在这16位受试者中,每位受试者都回输了最多有三个不同目标的基因改造T细胞。之后,研究人员发现这些编辑过的细胞开始在受试者的血液中循环,而且在肿瘤周围的浓度大于治疗前非编辑细胞的浓度。在治疗的一个月后,5位受试者病情稳定,说明他们的肿瘤没有生长。只有2人出现了可能因为这些编辑T细胞活性导致的不良反应。
也就是说,研究人员能利用CRISPR基因编辑技术改造免疫细胞,让这些细胞可以识别肿瘤患者的个体特异性突变蛋白。当这些细胞被注入患者体内时,这些经过基因编辑改造的 T 细胞优先流向癌细胞产生的位置,以消除癌细胞。
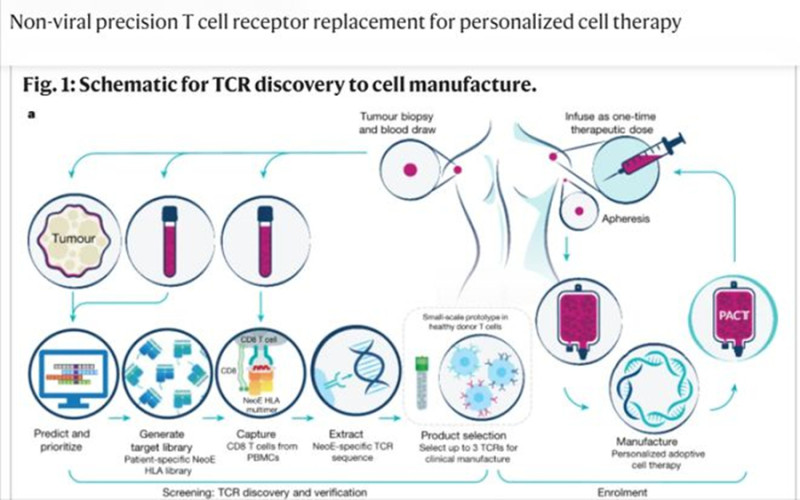
从“看病”下药到“看人”下药
基于基因技术的癌症治疗,让癌症从“看病”下药走向“看人”下药。这是人类首次利用基因编辑 T 细胞治疗癌症开始人体试验,可以说,这也是开发癌症个性化治疗的一个飞跃。
正如 Nature 杂志官方的新闻稿指出,这是个体化基因编辑和抗癌细胞疗法这两大热门领域的首次交汇,有望给癌症治疗带来深远的影响。该研究的通讯作者 Antoni Ribas也 表示:“这是利用孤立的免疫受体专门识别患者自身癌症突变的癌症个性化治疗的重大飞跃。”
不过,值得一提的是,想要真正实现个性化医疗,还需要突破两方面的障碍。一方面,就是技术成熟度的问题。就连研究人员们也强调这样的方法有一定的局限性,比如表征潜在抗原以及分离、克隆、测试 T 细胞受体都需要时间,而且患者特异性 T 细胞受体与相应抗原的亲和力各异。他们指出,一些流程在试验期间得到了优化,今后还有进一步优化的空间。
另一方面,一个不可回避的问题是,现代医学是否会接纳个性化的癌症治疗?众所周知,任何疾病治疗多需要遵循一定的治疗原则。比如,2021中国临床肿瘤学会(CSCO)指南会上,共有33部《指南》发布,其中23部更新,10部首次发布。这也是肿瘤领域临床治疗指南发布最多的一次。
中国临床肿瘤学会2016年开始出版指南,涵盖了常见恶性肿瘤诊治相关领域。过去5年,共发行近百万册,超过800名肿瘤学专家参与过指南编写。大规模随机对照的高级别临床研究证据,是制定指南的关键依据。通过随机对照试验得到的临床指南建立了排除个体差异的规范性诊疗指导。但是,这也必然导致临床指南的统计性证据给出的诊治方案只是一种概率有效性,对于具体的个体而言,其疗效往往不够“精确”。
这就与个性化医疗有所违背,可以预见,未来,如何平衡个性化治疗与遵循指南治疗将成为癌症治疗的一大考验。想要在个性化治疗与指南治疗中寻求到最优解,医生与患者达成相互理解和相互支持是第一步。
显然,肿瘤治疗非常复杂,肿瘤患者与肿瘤医生是“战友”,而医生与患者只有相互理解、相互支持,提高肿瘤医生的创新积极性,才能最终造福患者。尽管癌症凶险,但依然有很大一部分肿瘤患者都可以通过治疗获得很好的预后,甚至长期带癌生存。
此外,随着越来越多的个性化药物走向临床开发和批准,我们将如何应对个性化医疗带来的健康信息的增加?个性化医疗会加剧现有的医疗保健差距吗?我们如何确保隐私和机密性?接受基因检测的患者如何处理知情同意?
毋庸置疑,下一个十年里,我们将会看到更厉害的癌症治疗方法,重要的是,我们将如何迎接新技术的到来。